摘要:尼达尼布作为德国勃林格殷格翰研发的多靶点酪氨酸激酶抑制剂,核心作用是延缓肺功能下降,临床应用需严格遵循规范。本文全面梳理其用药指南,包括剂型规格、推荐剂量、服药要求等关键信息。
尼达尼布作为德国勃林格殷格翰研发的多靶点酪氨酸激酶抑制剂,核心作用是延缓肺功能下降,临床应用需严格遵循规范。本文全面梳理其用药指南,包括剂型规格、推荐剂量、服药要求等关键信息(注:相关用法用量参考境外上市标准,不作治疗依据,需遵医嘱),同时详细拆解肝肾功能不全、老年、妊娠哺乳期等特殊人群的用药注意事项,并给出胃肠道反应、肝酶升高等常见不良反应的应对策略,为临床安全用药提供权威参考。
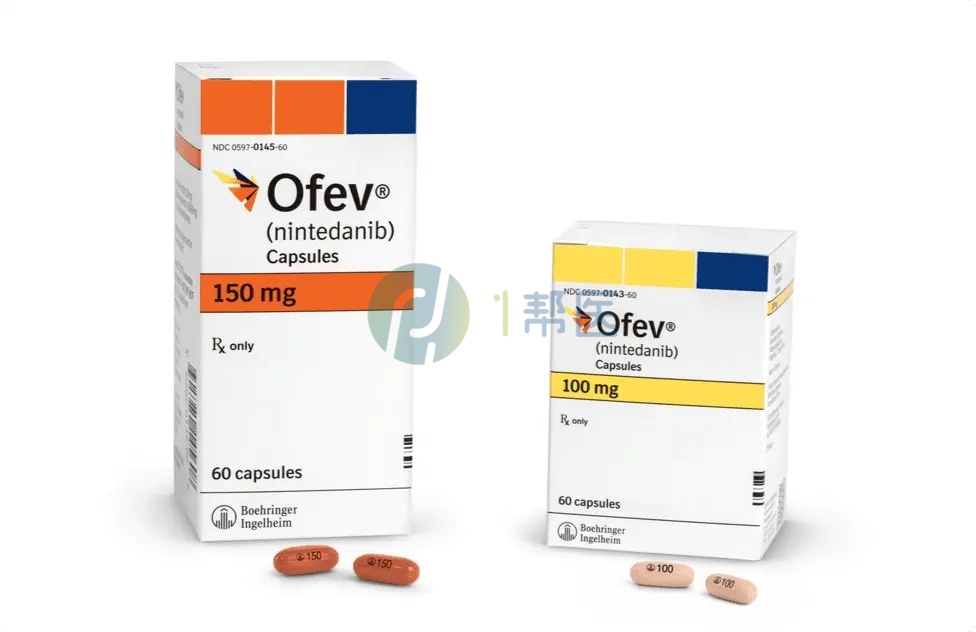
一、尼达尼布核心用药指南
以下仅反映尼达尼布在境外上市国家的用法用量标准,不作任何治疗参考,患者需严格遵医嘱用药。
1. 药物剂型和规格
尼达尼布主要以胶囊剂型供应,临床常见规格为100mg和150mg,不同规格适用于不同耐受程度及人群的剂量调整需求。
2. 服用剂量与时间
推荐剂量为每次150mg,每日2次;服药时间需间隔约12小时,规律用药可保证血药浓度稳定,提升治疗效果。需注意,若患者无法耐受150mg剂量,可在医生指导下降至100mg每日两次,若仍无法耐受则需停止治疗。
3. 服药核心要求
尼达尼布需随餐服用,可显著提升药物生物利用度;服药时应整粒用温水吞服,不可咀嚼、压碎或打开胶囊,因其内容物具有苦味,且破坏剂型可能影响药代动力学特性。若发生漏服,无需补服漏服剂量,在下一计划服药时间正常服用即可,不可超过每日300mg的最大剂量。
图片来自公开渠道(如FDA官网、原研药厂官网等),仅供参考。
二、特殊人群用药注意事项
1. 肝功能不全患者
尼达尼布超过90%通过胆汁/粪便排泄,肝脏功能状态直接影响药物代谢。其中,轻度肝功能不全(Child-Pugh A级)患者需慎用,用药期间需密切监测不良反应,必要时调整剂量或停药,推荐起始剂量可降至100mg每日两次;中度至重度肝功能不全(Child-Pugh B或C级)患者因安全性数据缺失,不建议使用。
2. 肾功能不全患者
由于小于1%的尼达尼布通过肾脏排泄,轻度至中度肾功能不全患者无需调整起始剂量;但严重肾功能不全(肌酐清除率<30mL/min)或终末期肾病患者,因相关临床数据有限,使用时需谨慎评估,用药期间需监测肾功能及蛋白尿情况,新发或加重蛋白尿时需考虑停药。
3. 老年患者
老年患者(≥65岁)使用尼达尼布的疗效和安全性与年轻患者无显著差异,无需常规调整起始剂量;但≥75岁的患者不良反应发生率相对更高,更可能需要通过降低剂量来管理不良反应。
4. 妊娠与哺乳期女性
尼达尼布具有明确的胚胎-胎儿毒性,动物实验已证实其可导致胎儿畸形和死亡,妊娠期女性仅在潜在获益远大于胎儿风险时,经充分评估后可使用,且育龄期女性用药期间需采取有效避孕措施。哺乳期女性用药时,药物可能通过乳汁分泌,为避免对婴幼儿产生潜在影响,建议用药期间停止哺乳,或根据药物对母亲的重要性决定是否停药。
三、常见不良反应与应对策略
1. 胃肠道反应(最常见)
腹泻是尼达尼布最常见的不良反应,发生率超60%,多在治疗前3个月出现。出现腹泻后,应首先及时补水防止脱水,饮食上选择清淡易消化食物,避免辛辣刺激食物;同时可使用洛哌丁胺等止泻药对症处理。若症状持续或加重,需及时告知医生,考虑减量或暂停用药,直至症状缓解后再评估是否恢复用药。
2. 肝酶升高
治疗前及用药期间需定期监测肝功能,若丙氨酸氨基转移酶(ALT)或天冬氨酸氨基转移酶(AST)升高至1.5-3倍正常值上限,且无中度肝损伤迹象,可中断治疗或降至100mg每日两次;若升高至3-5倍正常值上限,需暂停用药;若超过5倍正常值上限或出现中度肝损伤体征,应立即停药。肝酶升高多为可逆性,停药后可逐渐恢复。
3. 动脉血栓事件
尼达尼布可能增加动脉血栓事件风险,尤其是合并心血管基础疾病的患者。若用药期间出现急性缺血症状(如胸痛、肢体麻木、言语不清等),患者应立即就医,医生会根据情况考虑中断治疗。
4. 出血与胃肠道穿孔
用药期间可能出现异常出血、瘀伤等情况,与抗凝药物联用时风险升高,需监测凝血指标。近期接受腹部手术、有胃肠道穿孔病史或高风险的患者需慎用;若出现剧烈腹痛、呕血、黑便等症状,应立即停药并就医。
此外,吸烟会降低尼达尼布的药物暴露量,影响疗效,建议患者在治疗前停止吸烟,用药期间避免吸烟。与P-糖蛋白(P-gp)和细胞色素P450 3A4(CYP3A4)抑制剂合并用药时,尼达尼布暴露量可能增加,需密切监测患者耐受性。
 尼达尼布
尼达尼布 胶囊剂
100毫克|150毫克
 德国勃林格殷格翰
德国勃林格殷格翰
适用于治疗特发性肺纤维化(IPF)、进行性表型慢性纤维化间质性肺病(ILDs)的成人患者,也可减缓系统性硬化症相关间质性肺病(SSc-ILD)成年患者的肺功能下降速度。
2025-12-19 20:28:25
2025-12-19 20:21:49
2025-12-19 20:18:52
2025-12-19 20:12:18
2025-10-17 15:02:22
2025-10-17 14:57:11
2025-10-17 14:53:48
2025-10-17 14:47:33
2025-10-17 14:37:31
2025-05-23 14:06:41