摘要:因原研药上市后,存在20年的专利保护期,一般情况下,只有当原研药在国内的专利到期后,仿制药才可在国内上市,否则会因侵犯原研药的专利权,受到相应处罚。哪些仿制药可以在国内上市?满足以下条件的仿制药,可在国内申请上市[3]:1.原研药未在中国上市药品专利信息登记平台登记,这意味着原研药未在国内获得专利,因此不受我国《专利法》的保护,其仿制药即可申请上市;2.已登记并且获得专利的原研药,在中国的专利到期
因原研药上市后,存在20年的专利保护期,一般情况下,只有当原研药在国内的专利到期后,仿制药才可在国内上市,否则会因侵犯原研药的专利权,受到相应处罚。
满足以下条件的仿制药,可在国内申请上市[3]:
1.原研药未在中国上市药品专利信息登记平台登记,这意味着原研药未在国内获得专利,因此不受我国《专利法》的保护,其仿制药即可申请上市;
2.已登记并且获得专利的原研药,在中国的专利到期或者专利被宣告无效,如原研药的专利被发现侵犯了其他药品的专利,其专利将不再受我国《专利法》的保护;
3.原研药的专利未到期且有效,仿制药申请人在获得原研药专利人许可后,仿制药也可直接上市,如仿制药企通过和原研药企进行洽谈,对仿制药上市后的利益分成产生某些协定,或者仿制药企直接购买其允许上市的许可等;
4.原研药的专利未到期且受《专利法》保护,仿制药申请人承诺,其申请上市的仿制药即使获批,也不会在原研药专利到期之前,在国内进行售卖;
5.中国上市药品专利信息登记平台收录的原研药的专利应当被宣告无效,例如在临床上发现原研药的疗效低于10%,我国药监局将判定该药无效;
6.药品专利也有多种类型,如新化合物(新药)专利、药品制备方法专利、药品用途(疗效)专利等,若原研药申请哪项专利,《专利法》就保护哪项,例如原研药仅申请了新药专利,那么通过相同方法制备的仿制药,不会被判定为侵犯了原研药的专利权。

2018年8月,浙江京新药业研发的盐酸普拉克索片,获国家药监局(NMPA)优先审评,批准其在国内上市,这是我国首款获批的国产盐酸普拉克索片仿制药,随后在2020年1月2日,石药集团的盐酸普拉克索片仿制药也获国家药监局批准上市,并成为首款通过一致性评价的盐酸普拉克索片仿制药[2]。盐酸普拉克索片的原研药的专利应在2025年到期,那么,其国产仿制药为什么能提前7年在国内上市呢?
国产普拉克索片仿制药企业与德国勃林格殷格公司达成了某种利益协定,购买了该公司允许其仿制药提前上市的许可,其符合上述仿制药上市条件的第3条,才可在原研药专利到期前,提前7年在国内上市。
原研药的研发公司多为国际大型药企或大型制药公司,如美国辉瑞、拜耳、迈兰等公司,它们实力雄厚,资金充足,经验丰富,当然其中也有一些相对规模较小的制药公司,凭借自身的创新精神,研发出治疗某种疾病的首款药物(原研药概念)。而仿制药的研发公司相较于原研药公司多规模较小,其中的典型代表是印度仿制药企业,如太阳、卢修斯等,请详见《维奈托克:印度版仿制药受欢迎原因分析》。
仿制药参照是原研药,是一种与原研药在疗效、安全性、适应症类似的一种仿制品,因此,绝大多数原研药和仿制药的临床疗效和安全性基本一致,但需要注意的是,部分小型仿制药企因实力不足,可能会存在安全问题。
仿制药和原研药上市都需要在中国上市药品专利信息登记平台登记,均需遵守中国《药品管理法》,相较于原研药,仿制药的研发和上市用时更短,通常需以原研药为参考,创新其合成方法,通过验证其与原研药具有一致的疗效、安全性和质量等,即可简化其临床试验,总的研发时间一般10-13个月,而原研药一般需要几年,甚至十几年。
一般来说,患者更愿意选择原研药,所以原研药存在高昂的研发成本,价格贵,许多患者承受不起治疗的费用,转而选择等效价低的仿制药。
可通过一致性评价,证实仿制药和原研药具有一致的疗效和安全性,一致性评价[4]包括三个方面,体外药学、体内生物利用度和临床疗效。
体外药学是指药物的理化性质,如剂型、用法用量、规格、适应症等,可通过体外溶出试验,检验其与原研药是否一致。
药物的体内生物利用度,包括吸收程度和吸收速度,即药物进入人体后,在体内的代谢情况,可通过生物等效试验进行检测。
生物等效试验也是一种临床试验,通过测定血药浓度,比较不同的制剂对药物吸收的影响和差异,以推测其临是否存在差异以及患者能否接受这些差异,换句话说,生物等效性试验的目的是,评估两种制剂之间是否可以相互替换。
可设计仿制药对比原研药的临床试验,评估其临床疗效是否和原研药一致。
我国仿制药发展目前不及印度,归其原因是我国对原研药专利的保护严格,从而忽视了仿制药制度,导致仿制药发展受限,关于印度仿制药为何发展迅速,请详见《什么是仿制药?印度仿制药为何受欢迎》。
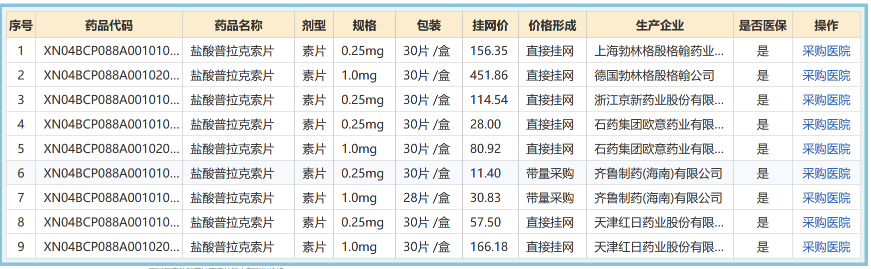
仿制药相对于原研药,药企的研发成本低,可以减少患者的经济负担,即便进入医保,原研药的价格也显著高于仿制药,以盐酸普拉克索片为例,德国勃林格殷格翰生产的原研药价格,是国产石药欧意仿制药的五倍以上。
我国鼓励仿制药研发,并对首个挑战原研药专利成功,并首个获中国药监局批准上市的化学仿制药,给予市场独占期。
首仿药获批上市后,国务院药品监督管理部门在一年内,将不再批准其他同种仿制药上市(共同挑战原研药专利成功的除外)[3]。
不仅如此,国家药监局在《深化药品审评审批改革进一步鼓励药物创新的意见》[5]中,也提出加快优先审评仿制药,提高仿制药审批的效率,如此可见,我国已意识到仿制药的重要性,如何在保护原研药的专利权的前提下,促进仿制药的发展,这将是我国《药品管理法》制定者面临的首要难题。
2025-09-12 14:36:44
2025-09-04 11:09:53
2025-08-26 22:25:43
2025-08-04 07:52:19
2025-08-04 07:25:36
2025-08-01 22:43:14
2025-07-27 11:47:00
2025-07-27 11:42:17
2025-07-27 11:16:10
2025-07-11 16:17:28